Ein Kölner Forschungsteam hat eine molekulare Perspektive auf die Architektur von Synapsen entwickelt. Ihre Studie zeigte, dass ein Protein im Gehirn flexible Filamente bildet und damit als wesentlicher Baustein inhibitorischer Synapsen dient / Veröffentlichung in „Nature Communications“
Köln/Germany, 19. September 2025. – Der überwiegende Teil der Synapsen, welche die Neuronen im Gehirn verbinden kommunizieren chemisch miteinander. Nur wenige werden über elektronische Impulse leitend. Der überwiegende Teil tauscht Informationen mittels Neurotransmitter aus. Wird eine Synapse häufiger verwendet, in etwa, wenn man Vorgänge wiederholt, so nimmt die Fläche der synaptischen Verbindung zu und es entsteht mehr Platz zur Übertragung von Neurotransmittern. Der Raum zwischen zweien solcher Synapsen wird als synaptischer Spalt bezeichnet. Bekannte Neurotransmitter sind bsw. Serotonin oder Dopamin. Der bekannte Adrenalinausstoß der etwa dann zum Tragen kommt, wenn man sich erschreckt, entleeren sich zur Aktivierung des peripheren vegetativen Nervensystems. Dieses ist für die Steuerung und Funktion der inneren Organe zuständig. Das Nervensystem ist autonom, arbeitet selbstständig, was hier geschieht, geschieht in der Regel unbewusst. Der Grund warum man niemanden vorsätzlich erschrecken sollte ist darin zu sehen das es durch einen solchen Adrenalinausstoss zu organischen Fehlfunktionen kommen kann.
Dopamin bsw. lässt gerne einmal Dinge erkennen, wo keine sind, wirkt also bsw. bei der Mustererkennung. Serotonin und Dopamin sind als Glückshormone bekannt.
Acetylcholin bsw. hat als Neurotransmitter die Aufgabe zwischen dem vegetativen Nervensystem und an der Schnittstelle zur motorischen Endplatte am Muskel zu agieren.
Die Neurotransmitter werden auf Vorrat in Vesikeln gehalten. Denkt das Gehirn, blitzt ein Neuron also auf, entleeren sich diese Vesikel, Neurotransmitter entleeren sich über den synaptischen Spalt und es kommt zur Kommunikation mit einem weiteren Neuron. Bei der Anzahl im denkenden Moment können runde 100.000 Neuronen aktiv sein.
Das Verhalten einer synaptischen Übertragung hängt allerdings vom Neurotransmitter ab, der entscheidet, ob eine Hemmung oder eine Erregung stattfindet. Wie Neuronen im Gehirn reagieren zeigt sich darin welche Neurotransmitter welche Aufgabe im Körper haben, was diese zu steuern hätten oder deren Kommunikation beeinflusst werden soll.
Inhibitorische Neurotransmitter haben die Aufgabe die Aktionspotenziale an den Synapsen zu mildern, zu hemmen. Ein solcher inhibitorischer Neurotransmitter ist bsw. Gamma-Aminonuttersäure oder Glycin. Beide sind für Hemmungen an den Synapsen beteiligt. D.h., die Kommunikation wird gehemmt. Was auch immer gedacht wird, es wird damit gehemmt.
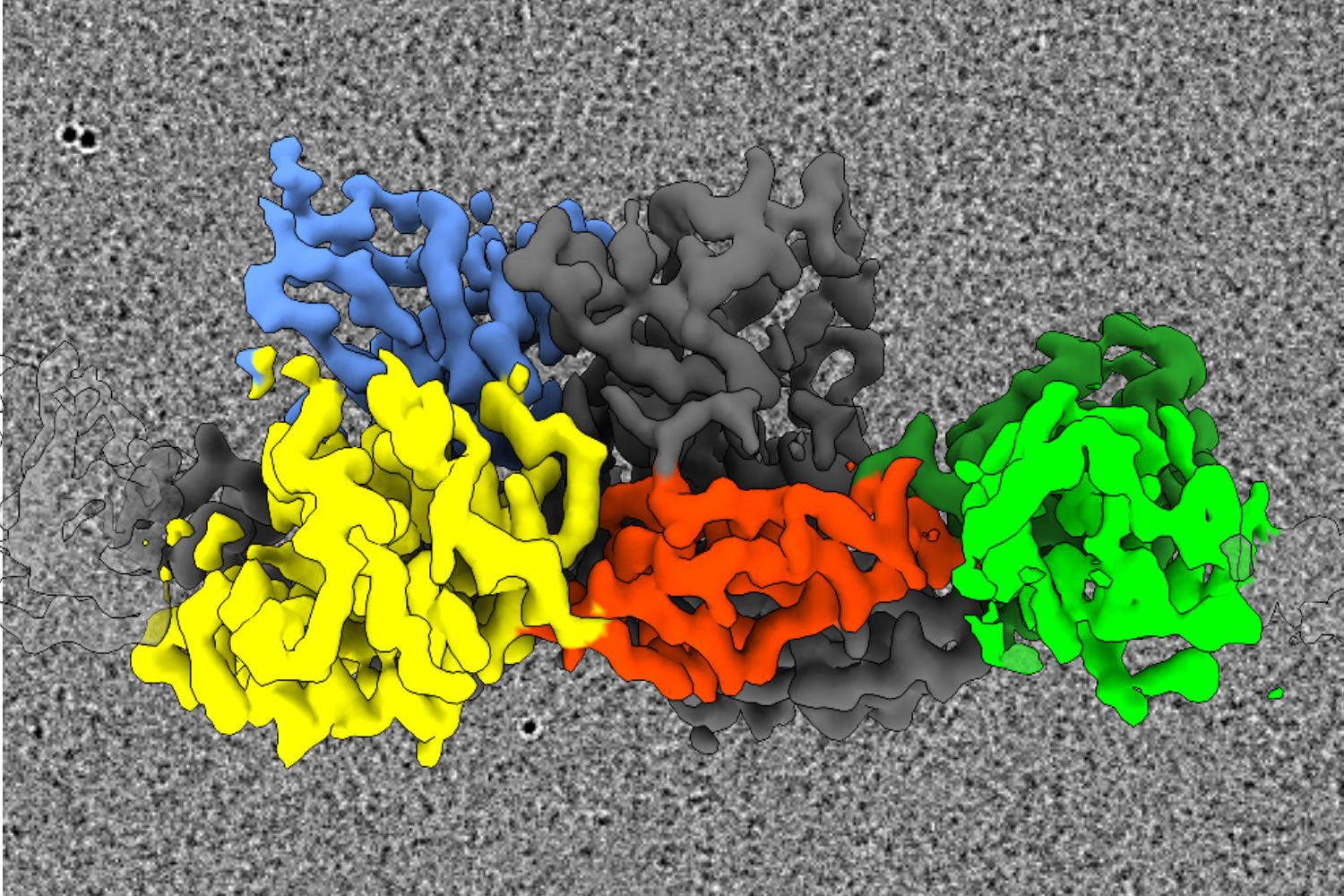
Forschende des Instituts für Biochemie der Universität zu Köln haben eine Schlüsselerkenntnis über die molekulare Grundlage der Synapsenbildung im zentralen Nervensystem gewonnen. Sie untersuchten inhibitorische Synapsen, die sogenannten „Bremsen“ in unserem Gehirn. Konkret untersuchten die Forschenden das Protein Gephyrin, das die eine Hälfte dieser Synapsen, die sogenannte postsynaptische Dichte, stabilisiert. Die in der Fachzeitschrift Nature Communications veröffentlichte Studie „Gephyrin filaments represent the molecular basis of inhibitory postsynaptic densities“ beschreibt eine bisher unbekannte Form der molekularen Interaktion im Protein Gephyrin, das durch diese Interaktion längliche Filamente bildet. Diese Filamente sind die organisatorische Grundlage für die Bildung der Postsynapse, was wiederum zur Bildung von Milliarden von Synapsen führt, die das Gehirn für quasi alle komplexen Funktionen der Kommunikation nutzt.
Unter der Leitung von Professor Dr. Günter Schwarz und Professor Dr. Elmar Behrmann verwendete das Team modernste Kryo-Elektronenmikroskopie, um die dreidimensionale Struktur von Gephyrin sichtbar zu machen. Ein überraschendes Ergebnis war, dass eine Domäne von Gephyrin, die an den Neurorezeptor bindet und Dimere (größere Strukturen aus einem Proteinpaar) bildet, verlängerte Filamente aufbaut. Bislang ging die Forschung davon aus, dass Proteine in phasengetrennten Kondensaten ungeordnet waren, doch Strukturen unter dem Mikroskop zeigten einen hohen Grad an Organisation. Zusätzlich zu dieser strukturellen Arbeit ergaben In-vitro-Experimente und Arbeiten an isolierten Zelllinien, dass diese Filamente für die Synapsenbildung erforderlich sind und erklärten, warum bestimmte Mutationen im Gephyrin neurologische Erkrankungen auslösen.
„Dies ist ein enormer Durchbruch für unser Verständnis der molekularen Bildung inhibitorischer Synapsen“, sagt Hauptautor Günter Schwarz. „Unsere Ergebnisse haben bedeutende Auswirkungen auf die Entwicklung neuer Therapien für neurologische Erkrankungen wie Epilepsie, die mit diesen Synapsen zusammenhängen.“
Elmar Behrmann, ebenfalls Hauptautor, fügt hinzu: „Durch den Einsatz der Kryo-Elektronenmikroskopie konnten wir die Gephyrin-Filamente in bisher unerreichter Detailgenauigkeit sichtbar machen. Dies hat uns ein tieferes Verständnis der molekularen Mechanismen hinter inhibitorischen Synapsen ermöglicht und neue Wege für die Forschung eröffnet.“
Erstautor Dr. Arthur Macha, ein Postdoktorand, der in beiden Labors tätig ist, sagt: „Wir waren zunächst überrascht, Z-förmige Schnittstellen zwischen Gephyrinmolekülen in unseren Daten zu finden. Diese Entdeckung schließt die Lücke in unserem Verständnis, wie die Anordnung der Rezeptoren, die Oligomerisierung von Gephyrin und die Synapsenbildung funktionell miteinander verbunden sind.“
Die Forschung wurde am Institut für Biochemie der Universität zu Köln durchgeführt, das über Expertise in den Bereichen Strukturbiologie, Protein-, Peptid- und Redox-Biochemie verfügt. Das Forschungsteam resümiert: Die Ergebnisse der Studie haben das Potenzial, das Verständnis der molekularen Grundlagen inhibitorischer postsynaptischer Dichten zu revolutionieren und werden die Grundlage für die Analyse der Architektur ganzer Synapsen auf einer neuen molekularen Ebene bilden.
Originalpublikation:
https://www.nature.com/articles/s41467-025-63748-w
Bildquelle
Copyright: Arthur Macha, Repräsentatives Kryo-Elektronenmikroskopie-Bild: eine eingefärbte Abbildung der 3D-Struktur von Gephyrin, die aus den Daten berechnet werden konnte.


Schreibe einen Kommentar